-
-
GLP-1侧链
 显示更多
显示更多 -
短肽中间体

-
Fmoc-His-Aib-OH
-
Fmoc-Ile-Aib-OH
-
Fmoc-Tyr(tBu)-Aib-OH
-
Fmoc-Glu(OtBu)-Aib-OH
-
Fmoc-His(Fmoc)-Aib-OH
-
Fmoc-His(Fmoc)-Aib-OSu
显示更多 -
-
替尔泊肽片段

-
CAS:2682040-93-1
-
CAS:3034670-52-2
-
CAS:1262308-37-1
-
CAS:2461524-68-3
-
CAS:2656383-24-1
-
CAS:2656383-25-2
显示更多 -
-
医药原料
 显示更多
显示更多 -
美容多肽
-
CG Oligo-1 寡肽-1
-
Whitide<sup>®</sup>Ⅰ 九肽-1
-
CG GHK-Cu 蓝铜肽
-
CG Arg 乙酰基六肽-8
-
CG Pal-GHK 棕榈酰三肽-1
-
CG Brightin<sup>®</sup>脱羧肌肽
显示更多 -
-
美妆原料
 显示更多
显示更多
-
深度解析 Salcaprozate Sodium (SNAC)促渗作用机制:助力大分子药物口服递送突破
发布时间:
2025-09-01
在大分子药物口服递送领域,如何有效提升药物肠道渗透性、解决口服生物利用度低的难题,一直是行业研究的核心方向。其中,SNAC(N-8‑(2‑羟基苯甲酰胺基) 辛酸钠) 作为一种高效的渗透促进剂,其独特的SNAC 促渗作用机制为大分子药物口服递送提供了关键解决方案,尤其在多肽类药物领域展现出显著优势。
大分子药物(如多肽药物)在跨细胞途径转运时,主要通过被动扩散、主动转运或内吞作用经由肠上皮细胞亲脂性膜实现转运,而提高药物亲脂性是提升肠道转运效率的关键。在众多增强多肽分子疏水性的方式中,SNAC (CAS No.:203787-91-1)凭借与药物分子的特殊相互作用脱颖而出。SNAC 作为小分子载体,可通过疏水离子对、共价或非离子相互作用与多肽分子结合,形成SNAC 多肽复合物,大幅提升多肽分子的亲脂性。其中,疏水离子对的形成过程类似成盐,带电荷的亲水性多肽分子与带相反电荷的 SNAC(CAS No.:203787-91-1) 形成物理复合物,借助 SNAC 中的疏水基团,降低多肽水溶性并增强其亲脂性,为药物穿透肠上皮细胞脂质双层膜奠定基础。
从SNAC(CAS No.:203787-91-1) 促渗作用机制的核心环节来看,SNAC 分子上的疏水芳香基团(2 - 羟基苯甲酰胺)发挥着关键作用。该基团可与多肽分子发生疏水相互作用,改变多肽分子构象,进而形成亲脂性更高的SNAC 多肽复合物。这种构象变化与亲脂性提升,能显著增加复合物在细胞脂质双层膜中的溶解度,最终提高其跨细胞被动转运效率。这一非共价相互作用具有普适性,在 SNAC 与肝素、胰岛素、色甘酸等多种药物形成的复合物中均得到验证。例如,在 SNAC 色甘酸复合物的 ¹H 核磁共振图谱中,可观察到 SNAC 的芳香质子高场位移,直接证明其 2 - 羟基苯甲酰胺基团参与了与色甘酸的相互作用;对于胰岛素,SNAC 通过非共价键作用及对胰岛素构象的改变,能增加胰岛素亲脂表面积,暴露出更易跨细胞渗透的疏水肽区域,从而提升胰岛素跨细胞渗透性。
在具体药物应用场景中,司美格鲁肽 SNAC 复合物的形成与作用机制尤为典型。在司美格鲁肽非肠溶包衣片中,SNAC 会在胃液中迅速与司美格鲁肽结合,形成包裹司美格鲁肽的复合物。这一复合物不仅能通过改变司美格鲁肽周围微环境 pH 值(使其 pH 升高),抑制胃蛋白酶活性(胃蛋白酶在低 pH 环境下活性更强),保护司美格鲁肽不被降解,还能借助SNAC 促渗作用机制,显著增加司美格鲁肽在胃肠道的渗透性,为口服司美格鲁肽制剂的临床应用提供了核心技术支撑。
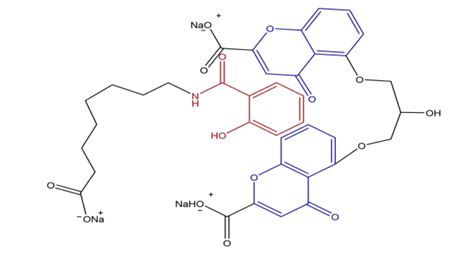
SNAC分子上的疏水芳香基团2-羟基苯甲酰胺
(红色)可因疏水作用插入色甘酸钠分子的两个苯并吡喃环;(蓝色)中而形成疏水性更高的复合物
值得注意的是,SNAC 与胃肠道消化液的相互作用也会对其促渗效果产生影响,这是SNAC 促渗作用机制中易被忽视的重要环节。研究表明,在 150 mmol/L SNAC 存在的情况下,环孢霉素 A、万古霉素和卵清蛋白等药物在猪肠粘液中的渗透性会发生变化。SNAC 可增强猪肠粘液的粘弹性和物理阻隔性能,但对猪胃粘液影响较小。这意味着,SNAC 虽能提升药物在胃肠道黏膜的渗透性,但也可能因增加胃肠粘液粘性,在一定程度上影响药物分子的扩散与吸收,这一特性在药物制剂研发中需重点考量,以实现 SNAC 促渗效果的精准调控。
除上述作用路径外,SNAC 在不同药物体系中的促渗表现也进一步印证了其机制的复杂性与适应性。例如,在多肽类药物之外,SNAC 对部分小分子大分子药物(如环孢霉素 A)的肠道渗透性也有调节作用,其通过与药物分子、肠道环境的多重相互作用,形成动态的促渗平衡。随着对SNAC 促渗作用机制研究的不断深入,以及对 SNAC 与不同药物、肠道环境相互作用的精准把控,SNAC 有望在更多大分子药物口服递送场景中发挥作用,推动口服大分子药物领域实现更大突破,为患者提供更便捷、高效的用药选择。
Sorry,当前栏目暂无内容!
您可以查看其他栏目或返回 首页
Sorry,The current column has no content!
You can view other columns or return Home



