替尔泊肽(Tirzepatide)的公斤级生产如何实现?需要哪些片段?
发布时间:
2025-08-19
本文来源于礼来的Michael O. Frederick团队,在June 17, 2021发表于Org. Process Res. Dev
摘要
复杂合成肽的大规模生产面临诸多挑战,包括制造风险(如产品规格不合格)以及通常较低的收率和纯度。为解决这些问题,我们开发了一种混合固相肽合成/液相肽合成(SPPS/LPPS)方法用于替尔泊肽的合成。通过连续生产和实时分析监测,确保了高质量产品的生产,同时纳米过滤技术实现了中间体的纯化,避免了复杂的沉淀步骤。该策略的实施效果显著,最终形成了高收率和高纯度的稳健工艺。
引言
合成肽是一种重要的药物形式,在多种疾病的治疗中应用日益广泛。分子量在1000–5000 Da之间的合成肽比典型的小分子(通常为200–600 Da)大得多,但比单克隆抗体等大分子(通常大于50,000 Da)小得多,属于独特的“中等分子”类别。合成肽既带来了合成挑战,也为新技术的开发和应用提供了机会。本文总结了一种针对III期候选药物替尔泊肽的新型合成路线的开发过程,包括采用混合SPPS/LPPS偶联策略组装分子、利用纳米过滤纯化中间体溶液,以及通过连续生产技术和实时分析数据确保高质量产品的生产。
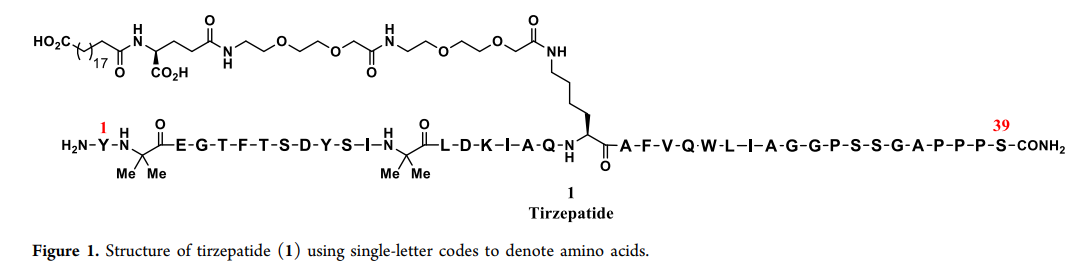
替尔泊肽结构
替尔泊肽(1,figure1)是一种新型的GIP(胃抑制多肽)和GLP-1(胰高血糖素样肽-1)双受体激动剂,用于治疗糖尿病、非酒精性脂肪性肝炎(NASH)和慢性体重管理。该分子目前处于III期临床试验阶段,II期研究显示其在显著降低HbA1c水平和减轻体重方面具有突出潜力,有望成为一流的肠促胰岛素疗法。替尔泊肽由39个氨基酸的肽链和第20位残基的侧链组成,其中37个为天然氨基酸,第2和第13位为非编码的氨基异丁酸残基。鉴于该分子的潜力,需要开发一种可扩展且稳健的生产工艺。
合成肽的制造方法多种多样,table1总结了近期获批药物的一些合成方法。合成方法的选择通常基于分子特征,如非编码氨基酸的存在、非肽侧链的存在以及氨基酸的数量。
常用于大分子(如单克隆抗体)的重组技术也可用于较小的肽。该方法将外源DNA移植到大肠杆菌或哺乳动物(中国仓鼠卵巢,CHO)细胞株中,由细胞合成肽。虽然开发时间通常比典型的合成方法长,但该方法已成功用于半合成肽(如索马鲁肽、德谷胰岛素和利拉鲁肽)。该方法的两个缺点是:(1)难以引入DNA未编码的氨基酸;(2)难以引入非肽侧链。
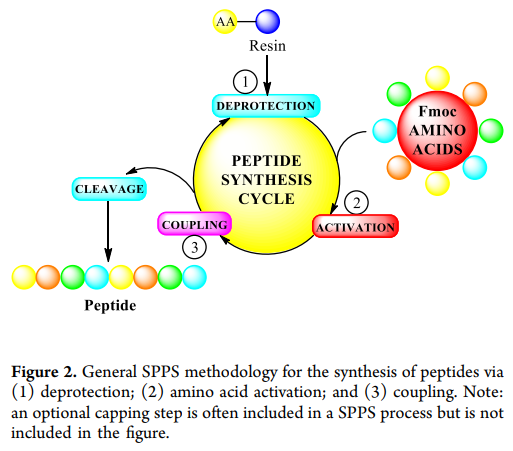
另一种常见的方法是固相肽合成(SPPS)。该方法由Merrifield于1963年首次提出,通过在树脂上逐步偶联氨基酸来合成肽链。典型的SPPS循环(figure2)包括:(1)脱保护(通常用哌啶去除Fmoc保护基);(2)活化下一个氨基酸;(3)将活化的氨基酸偶联到树脂上的生长肽链。重复这一循环可合成受保护的肽,随后通过切割树脂并去除保护基得到目标肽(某些情况下,可能需要“软切割”保留保护基的肽或肽片段)。早期的SPPS使用N-α-Boc保护的氨基酸作为关键构件,每次循环需用大量HF去除Boc基团。为避免使用HF,近20年来研究人员转向使用N-α-Fmoc保护的氨基酸,以哌啶进行脱保护。SPPS已成功用于多种中等分子(如利司那肽和艾塞那肽),包括在合成过程中引入非编码氨基酸。然而,SPPS在合成较长肽链(通常>30个氨基酸)时收率和纯度较低,且由于需要连续执行大量单元操作而具有较高的制造风险(>30个氨基酸的肽链失败率估计为20%)。
另一种常见的方法是液相肽合成(LPPS)。该方法与SPPS类似,但生长中的肽链不连接树脂,且肽的C端为非反应性酰胺或保护的酯。该方法适用于较小的肽链(≤10个氨基酸,如地加瑞克),但随着肽链增长,收率和纯度会迅速下降。
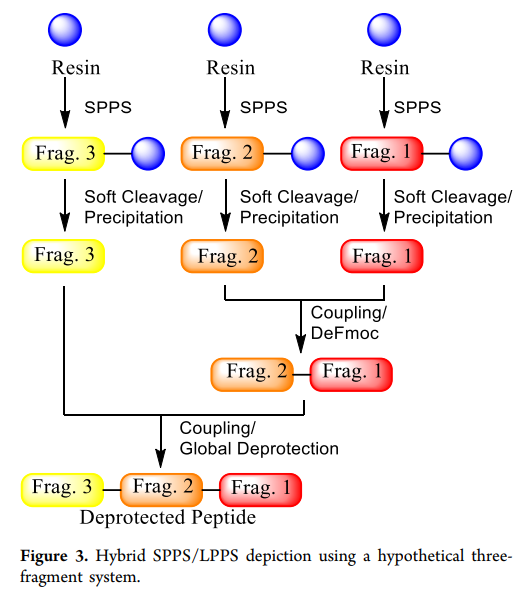
最后一种选择是混合SPPS/LPPS方法(以下简称“混合方法”)。该方法通过SPPS合成高纯度的短肽片段作为中间体,避免了长链SPPS合成中的制造风险和纯度问题。随后,这些受保护的片段在液相中偶联(LPPS,figure3展示了一个假设的三片段混合合成示意图)。尽管该方法过去应用较少(如恩夫韦肽),但我们认为其具有吸引力。
为实现混合工艺,首要任务是选择适合通过LPPS偶联的片段。片段选择的关键考虑因素包括肽链长度、片段总数、断开点氨基酸的特性以及侧链。片段的大小和数量很重要,因为更多的小片段虽然纯度高,但会增加制造负担和LPPS步骤;而较少的大片段虽然制造负担较轻,但纯度和制造风险更高。综合这些因素,我们选择了四个片段用于替尔泊肽的合成。对于断开点,一个关键因素是每个片段C端氨基酸的外消旋化倾向,因为酰胺骨架的α-立体中心比SPPS中使用的Fmoc保护氨基酸更容易外消旋化。经过多种片段探索,最终选定了四个片段(2–5,figure4)。这些片段均为易分离的固体,纯度极高(97.5–99.5%)。
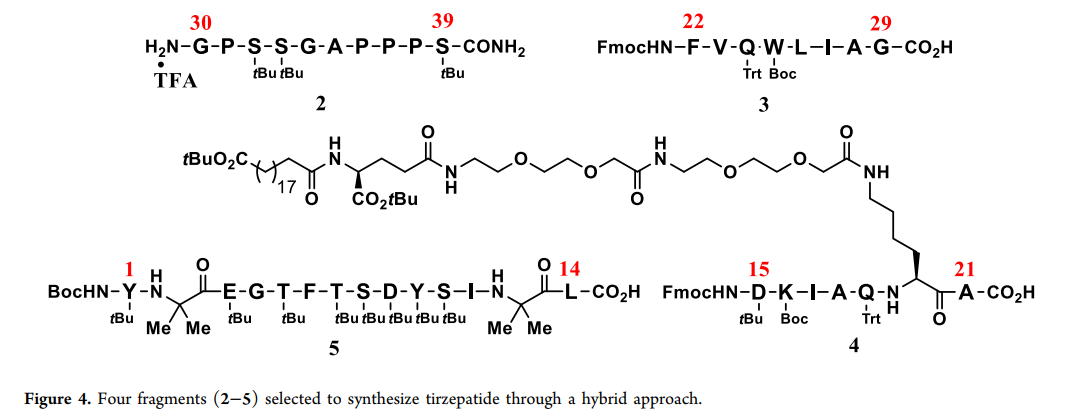
初步研究在小规模上使用四个片段(2–5)进行,验证了混合方法的可行性。研究发现,在放大至千克级生产前,两项新技术可显著提升肽的制造水平。第一项技术是使用切向流过滤(特别是纳米过滤)纯化中间体,避免沉淀步骤,因为长肽易形成凝胶且难以分离。第二项技术是采用连续生产并结合在线高效液相色谱(HPLC)分析,确保高质量产品的生产,降低制造风险,减少浪费和成本。
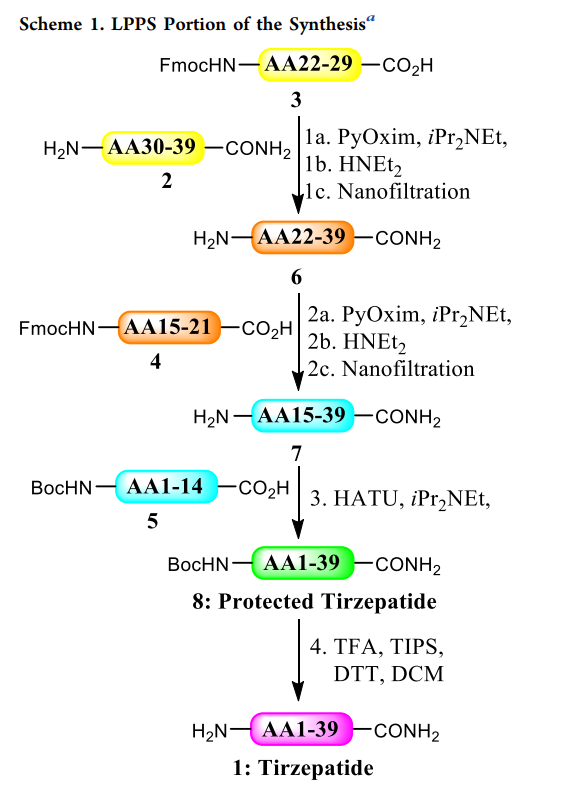
本次生产目标是分四批完成千克级替尔泊肽粗品的合成。工艺的第一步是将片段2和3(分别代表氨基酸30–39和22–29)偶联(所有LPPS步骤见scheme1)。片段2和3的溶液分别溶于二甲基亚砜(DMSO)和乙腈(ACN),PyOxim溶于ACN,另加入纯的二异丙基乙胺,通过流动系统在进入柱塞流反应器(PFR)前混合以确保均一性(step1的设备设置见figure5)。
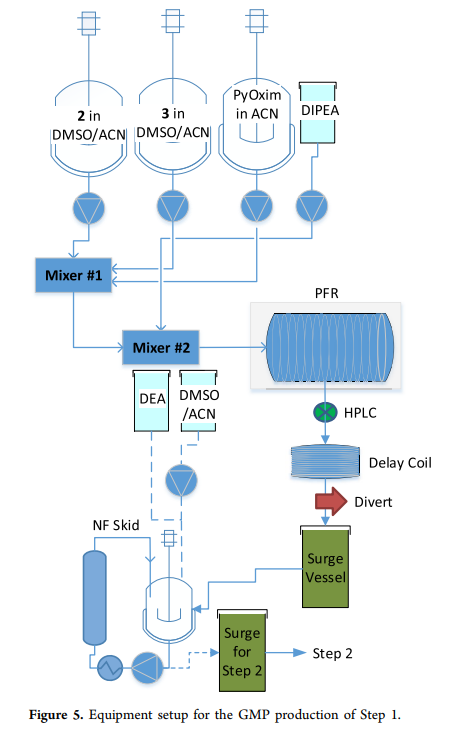
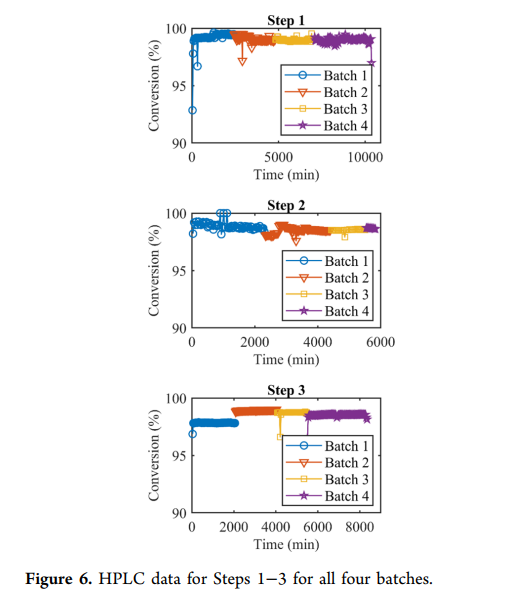
流动系统中的偶联反应结合过程中测试,可实时监测反应质量并调整化学计量。符合反应规格的物料进入缓冲罐等待下一步,不合格物料将被分流(最终废弃),并通过调整不同物料的流速确保缓冲罐中收集的物料均符合质量要求(需注意的是,三个偶联step均未出现分流情况,所有物料均达到过程目标)。step1的溶液在柱塞流反应器(PFR)中停留时间为3小时,每36分钟通过HPLC采样一次。采样后剩余45分钟反应时间,用于分析样品以确保物料质量,随后溶液进入缓冲罐(生产活动的HPLC结果见figure6)。另一种方法是在柱塞流反应器(PFR)末端采样并安装延迟线圈,其长度超过分析所需时间。缓冲罐装满后,溶液用二乙胺(DEA)(20当量,1小时)脱保护,随后通过纳米过滤去除二乙胺、二乙胺-二苯并富烯(DBF)加合物及偶联相关杂质。纯化后的DMSO/ACN溶液(含氨基酸22–39的片段6)储存于另一缓冲罐中,等待step2。
纳米过滤是一种基于膜的技术,可根据分子量和疏水性分离溶液中的成分。粗反应溶液通过膜后,小分子量杂质(如二苯并富烯(DBF)、二乙胺(DEA)和PyOxim相关副产物(PyO))被去除,而目标肽被保留(figure7)。类似技术(如切向流过滤和超滤)常用于大分子药物(如单克隆抗体),但超滤膜通常不适用于有机溶剂体系和短肽片段。由于肽的分子量较大(>2000 Da),纳米过滤成为可能。许多纳米过滤/超滤膜与有机溶剂不兼容,但一些陶瓷基膜可耐受DMSO、ACN、DMF和DEA。孔径的选择需平衡低通量(孔径过小)和高肽损失(孔径过大)。

step1中,200 Da孔径的膜(制造商Inopor称其孔径<0.9 nm)可实现较低的肽损失。产物首先被浓缩以减少体积和循环时间,通过纳米过滤器的8倍溶剂体积足以去除低分子量杂质(如二乙胺、二苯并富烯和PyOxim相关杂质)。DMSO和ACN溶剂冲洗液被循环并加入最终产物中以回收膜上的肽,并将最终溶液稀释至下一步的目标浓度。最终得到纯化的片段6(AA22–39)溶液,三步操作的总收率为75–80%。
step2的条件与step1类似。使用柱塞流反应器(PFR)将片段6(含氨基酸22–39)和片段4(含氨基酸15–21)的DMSO:ACN溶液与iPr2NEt和PyOxim在20°C下偶联,停留时间为3小时。通过在线HPLC监测,确保四批生产中的高转化率(figure 6)。偶联后,用二乙胺去除Fmoc保护基,粗溶液通过纳米过滤纯化。采用450 Da孔径的陶瓷膜(0.9 nm孔径,由于片段7的分子量高于片段6,可使用较大孔径)去除低分子量杂质(二乙胺、二苯并富烯和PyOxim相关副产物),同时将溶剂置换为二甲基甲酰胺(DMF),得到纯化的片段7(含氨基酸15–39)溶液,三步操作的总收率为68–75%。
step1和2的条件在step3中效果不佳,原因是片段5(含氨基酸1–14)的亮氨酸-14残基外消旋化水平较高。经过广泛优化,最终采用HATU与iPr2NEt在DMF和少量ACN(用于HATU进料,因该试剂在DMF中不稳定)中于0°C下反应。反应混合物通过柱塞流反应器(PFR),停留时间为3小时,目标为完全转化且D-亮氨酸异构体含量低于0.5%。随后通过沉淀纯化,因为step3的纯化无法使用纳米过滤(溶剂置换为TFA,主要用于step4)。幸运的是,使用NaCl和NaHCO3水溶液可顺利沉淀,经分离干燥后得到受保护的替尔泊肽(8),step3的收率为95–100%。
最后一步是去除片段8上的19个酸不稳定性保护基。采用标准SPPS切割和脱保护条件,使用TFA、TIPS和二硫苏糖醇(用于与切割的保护基反应)以及DCM和水(增加溶解度)在21°C下反应3小时,完全去除所有保护基。通过加入甲基叔丁基醚(MTBE)沉淀替尔泊肽粗品(1)。为避免球形团聚,需严格控制加料速度,分两阶段进行:初始缓慢加料(90分钟内加入40%)以最小化放热,随后快速加料(45分钟内加入剩余60%)以避免开发过程中观察到的团聚现象。固体经分离干燥后,得到替尔泊肽粗品1,step4的收率为75–85%。
混合策略旨在降低替尔泊肽的制造风险,并实现高收率和高粗品纯度的工艺。所有目标均达成,工艺在生产中表现稳健(三个偶联step的转化率数据见figure6),合成肽的总收率较高(粗品收率46%),粗品纯度超过70%。与小分子药物通过结晶纯化API不同,肽需要通过色谱纯化去除相关肽杂质。粗API的更高纯度可简化纯化步骤并提高总收率。
此外,混合杂质主要由过量片段化学计量引起,这些杂质可通过色谱轻松去除,进一步简化了纯化过程。模块化的混合方法还便于优化,自本次生产活动以来,已实现了显著改进(LPPS收率>55%,粗品纯度>80%)。
结论
本文描述了替尔泊肽千克级生产的混合SPPS/LPPS策略的开发与实施。通过连续生产、实时分析监测和纳米过滤中间体纯化等新技术,实现了高质量产品的生产。这一成功为未来肽药物的生产提供了潜在应用价值。
同隽医药合成和生产替尔泊肽多个片段,包括CAS:2682040-93-1、CAS:3034670-52-2、CAS:2656383-23-0、CAS:2461524-68-3、CAS:2656383-24-1、CAS:2656383-25-2,提供价格优质量高的原料,欢迎联系我们!




